La vaccination est primordiale pour protéger la population contre des maladies aux conséquences potentiellement graves. Mais comment les vaccins sont-ils créés ? Comment s’assure-t-on qu’ils sont efficaces et sans danger ? Présentation des phases de développement, communes à tous les vaccins.
Le développement des vaccins : une procédure stricte
Dans un contexte où certaines personnes sont méfiantes face aux vaccins, la semaine de la vaccination est l’occasion de mettre en lumière les étapes qui précèdent la mise sur le marché d’un vaccin.
Avant de recevoir le feu vert pour être mis à la disposition du public, un vaccin est soumis à une procédure d’essais précliniques et cliniques rigoureuse. Lors de ces essais, on vérifie que le vaccin assure la protection espérée et qu’il ne provoque pas d’effets indésirables graves fréquents.
Le développement des vaccins : 5 étapes
Le développement de tout vaccin s’effectue suivant une même procédure stricte. Celle-ci requiert :
- Une phase préclinique
- Des essais cliniques en 3 phases
- Un suivi continu de l’efficacité et de la sécurité
Phase préclinique :
Dans un premier temps, le vaccin en développement est expérimenté pour constater s’il produit une réponse immunitaire et s’il ne montre pas d’effets indésirables graves sur les animaux.
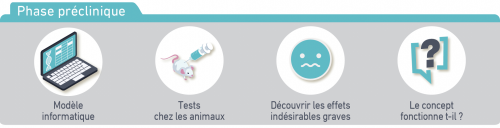
Lors de cette première phase de développement, si le vaccin fonctionne et les tests sur les animaux ne montrent pas d’effets indésirables importants, des essais cliniques peuvent alors être effectués chez l’être humain.
Essais cliniques en 3 phases :
Le vaccin est ensuite testé chez l’humain lors d’essais cliniques en 3 phases. Le vaccin est alors administré à des groupes de personnes de plus en plus importants.
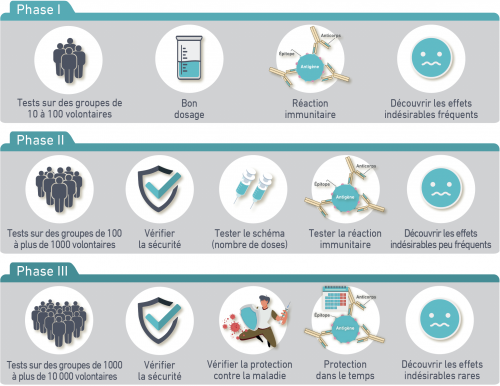
Lors de ces 3 phases, les volontaires comme les scientifiques ignorent quels sont les volontaires qui ont reçu le vaccin ou le placebo. Ainsi, personne n’est influencé dans son évaluation. L’information est seulement divulguée une fois qu’un essai est conclu et tous les résultats finalisés.
Lorsque les 3 phases d’essais cliniques sont terminées, les autorités sanitaires examinent la sécurité et l’efficacité du vaccin. Si cette évaluation est positive, le vaccin reçoit une « autorisation de mise sur le marché ». Cette autorisation est délivrée au niveau européen par l’Agence européenne des médicaments (EMA) et, en Belgique, par l’Agence fédérale des médicaments et produits de santé (AFMPS).
La phase 4, le suivi continu de la sécurité et de l’efficacité des vaccins :
La phase 4 est réalisée après la commercialisation du vaccin. Lors de la vaccination à grande échelle, cette phase permet de suivre si des effets indésirables, parfois très rares mais pouvant être graves, surviennent chez un nombre important de personnes vaccinées. Les politiques d’utilisation des vaccins sont alors ajustées en fonction des données récoltées.

Le service Qualité des vaccins et des produits sanguins de Sciensano assure un contrôle de qualité indépendant des lots de vaccins avant leur commercialisation en Belgique et en Europe. Ce contrôle indépendant est effectué après les contrôles réalisés par les firmes pharmaceutiques.
Sciensano fait partie du Réseau européen de laboratoires officiels de contrôle des médicaments (OMCL). La Direction européenne de la qualité des médicaments et des soins de santé coordonne ce réseau, qui teste tous les lots de vaccins destinés à l’Europe. Les tests indépendants de chaque lot de vaccins garantissent leur qualité et leur conformité aux spécifications du produit. Lorsqu’un lot de vaccins est testé par l’un des laboratoires du réseau, le certificat délivré est reconnu par tous les pays de l’Union Européenne. Les lots de vaccins distribués par les fabricants en Belgique sont donc testés et approuvés soit par Sciensano, soit par un autre laboratoire du réseau européen.
Plus d’informations : Comment un vaccin est-il mis sur le marché ?
Qu’en est-il de la rapidité de développement du vaccin contre la Covid-19 ?
Comme pour tous les vaccins, le développement du vaccin contre la Covid-19 a suivi une procédure très stricte.
En temps normal, les étapes de développement d’un vaccin se suivent l’une après l’autre. Compte tenu de l’urgence sanitaire et de l’importance de la lutte contre la Covid-19, contrairement au processus habituel, plusieurs étapes se sont déroulées en même temps. Ce qui a permis de développer des vaccins plus rapidement.
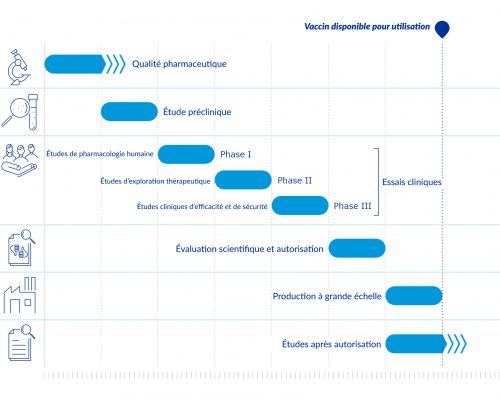
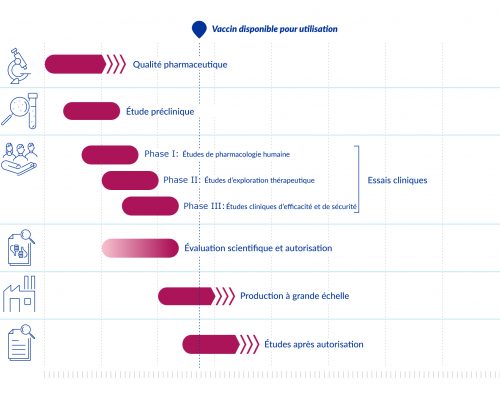
Source : Agence européenne des médicaments
D’autres facteurs ont favorisé la mise sur le marché rapide de vaccins contre la Covid-19 :
- Les connaissances acquises par le passé sur d’autres formes de coronavirus et les connaissances acquises en matière de développement de vaccins.
- Davantage de ressources humaines et financières ont été mobilisées à travers le monde entier.
- Un nombre très important de personnes se sont portées volontaires pour les essais cliniques (pour certains vaccins, plus de 40.000 personnes).
- L’évaluation des différentes phases par les autorités sanitaires a été réalisée en continu, dès que de nouveaux résultats étaient disponibles. Cette méthode a permis une prise en charge plus rapide des dossiers rentrés par les firmes pharmaceutiques.
Le processus de développement et d’approbation des vaccins contre la Covid-19 est donc performant.
Toutes les étapes de la procédure de mise sur le marché ont été respectées et les vaccins doivent répondre aux mêmes exigences que tous les autres vaccins. Ce n’est que lorsqu’il existe des preuves de la qualité, l’efficacité et la sécurité d’un vaccin qu’un avis positif est donné pour son autorisation de mise sur le marché.